SARS-CoV-2 – etiologický agens COVID-19: ZATIAĽ VIAC OTÁZOK AKO ODPOVEDÍ
V súčasnosti sme svedkami nečakanej pandémie COVID-19 (Coronavirus disease 2019), ktorej etiologickým agensom je koronavírus SARS-CoV-2. V tomto článku sa sústredíme na niektoré doteraz poznané aspekty nového koronavírusu z pohľadu molekulovogenetických štúdií. Ako uvidíme, vedecké fakty vyvracajú niektoré hoaxy a konšpiračné teórie.
Všeobecné vlastnosti koronavírusov
SARS-CoV-2 patrí do čeľade Coronaviridae, rod Betacoronavirus. Genóm koronavírusov je nesegmentovaná pozitívne orientovaná RNA o dĺžke asi 30 000 nukleotidov (30 kb). Dve tretiny genómu koronavírusov kódujú 16 neštruktúrnych bielkovín a jedna tretina sa podieľa na syntéze štruktúrnych vírusových bielkovín. Okrem membránového (M), obalového (E) a nukleokapsidového (N) proteínu je najdôležitejším proteínom S glykoproteín, ktorý pri interakcii vírusu s bunkou zabezpečuje väzbu vírusu na bunkový receptor. S proteín je štiepený bunkovou furín-like proteázou na dve podjednotky S1 a S2. Podjednotka S1 obsahuje RBD (receptor binding domain – doména viažuca sa na receptor).

Obr. 1. Štruktúra viriónu SARS-CoV-2
S2 tvorí stopku výčnelkov spike proteínu (Obr. 1.) a zabezpečuje fúziu vírusu s bunkovou membránou.
Koronavírusové ochorenia a ich základne klinické príznaky
Koronavírusy spôsobujú ochorenia s rôznou závažnosťou. V súčasnosti poznáme 7 ľudských koronavírusov. Obvyklými ľudskými koronavírusmi sú alfakoronavírusy 229E, NL63 a betakoronavírusy OC43, HKU1, ktoré vyvolávajú menej nebezpečné hnačky alebo respiračné ochorenia s postihnutím horných dýchacích ciest. Tieto vírusy sa zvyčajne nedostanú do dolných častí dýchacích ciest, ako je to pri neskôr rozpoznaných ochoreniach SARS (Severe Acute Respiratory Syndrome – ťažký akútny respiračný syndróm), MERS (Middle East Respiratory Syndrome – Blízko-východný respiračný syndróm) a terajšom COVID-19.
SARS. Je to závažné, často smrteľné ochorenie vyvolané vírusom SARS-CoV, prebiehajúce ako ťažká pneumónia (zápal pľúc). Vírus sa preniesol na človeka z cibetiek, ktoré boli infikované netopiermi. Hlavnými príznakmi infekcie sú horúčka, ťažkosti s dýchaním, bolesti hlavy a bolesti svalov. SARS sa objavil v roku 2003 v Číne, Hongkongu a na Taiwane, kde je zvykom konzumovať mäso z cibetiek. Epidémia SARS si vyžiadala okolo 800 obetí v 30 krajinách. Od roku 2004 nie sú známe nové prípady infekcie týmto typom koronavírusu.
MERS. Je to vírusové respiračné ochorenie vyvolané vírusom MERS-CoV, ktoré prvýkrát vypuklo v roku 2012 v krajinách na Blízkom východe. Neskôr sa zistilo, že bolo na človeka prenesené z tiav, ktoré tento vírus získali z netopierov, a bolo označené ako prenosné z človeka na človeka. V nasledujúcich rokoch vypukli ďalšie menšie epidémie. Vírus spôsobuje závažnú pneumóniu s mortalitou 30 – 40 %. Uvádza sa, že koronavírus infikoval okolo 2 500 ľudí, usmrtil viac ako 800 pacientov, v nasledujúcich rokoch pribudli ešte stovky pacientov.
V súčasnosti čelíme pandémii COVID-19 spôsobenej vírusom SARS-CoV-2.
OBJAV SARS-CoV-2
Ako objaviť nový vírus, keď o ňom nič nevieme?
V prípade SARS-CoV-2 sa vychádzalo z klinických príznakov pozorovaných na infikovaných pacientoch. Zvýšená teplota, zápal dolných dýchacích ciest a výskyt v zimnom období na mokrom trhu v Číne nabádal odborníkov, že problémy mohli byť spôsobené koronavírusom. Veď SARS-CoV bol objavený za podobných podmienok. Vzorky z pacientov boli poslané do vedeckého laboratória vo Wuhane (Čína), kde na detekciu vírusu využili RT-PCR test, ktorý detegoval všetky koronavírusy – a výsledky boli pozitívne. Takže bol to koronavírus, ale aký?
Dnes, keď máme k dispozícii vírusovú vzorku, je v špičkovom laboratóriu možné pomerne ľahko prečítať metódou NGS (next generation sequencing) jeho genetickú informáciu, ktorou osekvenujeme aj neznámu DNA (RNA genóm vírusu sa prepíše do DNA). Z množstva získaných sekvencií zo vzorky vedci poskladali celý genóm SARS-CoV-2 aj s pomocou poznatku, že organizácia jeho genómu je podobná ako u iných koronavírusov. A potom nasledovalo porovnanie sekvencií so sekvenciami ostatných koronavírusov, fylogenetické analýzy a odkrytie unikátnych vlastností SARS-CoV-2.
Unikátne vlastnosti SARS-CoV-2
Pre pochopenie možného pôvodu tohto nového koronavírusu je potrebné poznať jeho genetické vlastnosti. Tie sme spoznali porovnaním nukleotidových a počítačom dedukovaných aminokyselinových sekvencií získaných zo SARS-CoV-2 a iných koronavírusov. Na základe týchto relatívne rýchlych štúdií sa zistilo, že genóm SARS-CoV-2 má dve unikátne vlastnosti:
- Unikátne mutácie v receptor-viažucej doméne RBD
Vírus interaguje s bunkou tak, že časť S proteínu – RBD, ktorá je umiestnená na povrchu vírusu, sa viaže na bunkový receptor. Rýchla identifikácia RBD na S proteíne bola urobená na základe porovnania sekvencií SARS-CoV-2, SARS-CoV a iných koronavírusov. V RBD, ktorá je na podobnom mieste v S proteíne, ako bola nájdená u SARS-CoV, bolo zistených 6 kritických aminokyselín pre väzbu k bunkovému receptoru. Štúdie naznačili, že RBD SARS-CoV-2 je unikátna a má až 5 aminokyselín odlišných od RBD pre SARS-CoV (Obr. 2.).
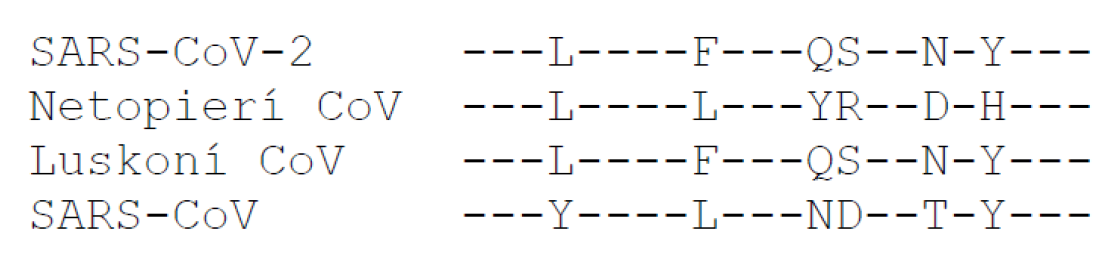
Obr. 2. Porovnanie kľúčových aminokyselin v oblasti RBD u koronavírusov
Identifikácia bielkovinového receptora ACE2 (angiotensin-converting enzyme 2 – enzým konvertujúci angiotenzín) na ľudských pľúcnych bunkách pre SARS-CoV-2 vychádzala tiež zo štúdia SARS-CoV, kde bol tento bunkový receptor identifikovaný.
Na základe počítačových štruktúrnych štúdií a biochemických analýz sa potvrdilo, že SARS-CoV-2 so svojou unikátnou RBD sa silne viaže k ACE2 nielen ľudských buniek, ale aj buniek fretiek, mačiek a iných živočíchov. To vysvetľuje nedávnu identifikáciu SARS-CoV-2 u tigra v zoo v Bronxe (USA) a protilátok u mačiek. Počítačové štruktúrne analýzy zároveň odkryli, že táto väzba nie je ideálna a je tu evolučný priestor na jej zdokonaľovanie, napr. mutáciou niektorej aminokyseliny, čo by mohlo spôsobiť ďalšie problémy u ľudí.
Aký je mechanizmus prieniku vírusu do bunky? Pre vstup vírusu do bunky je potrebná interakcia vírusu s bunkovým receptorom ACE2 a súčinnosť TMPRSSA (type II transmembrane serine protease – transmembránová serínová proteáza typ II). Vírusový S proteín sa pomocou RBD viaže na bunkový receptor ACE2. Potom sa TMPRSSA naviaže na tento komplex a odštiepi ACE2 receptor, čím je S proteín aktivovaný – vírus môže vstúpiť do bunky a začať ovládať bunkový aparát.
- Unikátne polybázické furínom rozpoznávané štiepacie miesto
Porovnanie sekvencií koronavírusov, ktoré kódujú S proteín, odkrylo inzerciu 12 nukleotidov na rozhraní S1 a S2 podjednotiek, ktorá nebola pozorovaná v žiadnom genóme betakoronavírusov, s výnimkou SARS-CoV-2. Tieto nukleotidy kódujú 4 aminokyseliny PRRA (Obr. 3), ktoré sú inzerciou v S proteíne SARS-CoV-2. Tým sa vytvorilo polybázické furínom (proteáza) rozpoznávané štiepacie miesto RRAR (Obr. 3., podškrtnutá sekvencia aminokyselín) pre štiepenie S proteínu na podjednotky S1 a S2, čo sa prejavuje v infekčnosti vírusu a rozsahu vírusových hostiteľov.

Obr. 3. Porovnanie aminokyselín v oblasti štepiaceho miesta pre rôzne koronavírusy
Uvedená inzercia aminokyselín zároveň vytvára nové „O-linked glykan“ miesto, o funkcii ktorého zatiaľ nevieme.
Odkiaľ pochádza SARS-CoV-2?
Je to otázka, ktorá sa prirodzene vynára medzi prvými, ale definitívnu odpoveď ešte nepoznáme. Napriek tomu sme za krátku dobu postúpili predsa len bližšie k odpovedi.
Prvým podozrením bolo, že vírus bol umelo skonštruovaný. Ako uvidíme, nie je to pravda. Čo svedčí proti? Vírus má unikátne štruktúry popísané vyššie, ktoré nie sú typické pre iné koronavírusy, a teda kto by ich vedel dopredu navrhnúť tak, aby boli biologicky funkčné? Keby na to boli použité dnes známe metódy reverznej genetiky, v genóme vírusu by sme pozorovali isté molekulové stopy, ktoré však zistené neboli. Takže, keď vyjdeme z týchto východísk, umelá konštrukcia SARS-CoV-2 je konšpirácia.
Pri triezvej vedeckej úvahe musíme pôvod nového koronavírusu hľadať inde:
- Prírodná selekcia na zvieracom druhu a potom prenos na človeka.
Vzhľadom na to, že vírus bol identifikovaný na mokrom trhu vo Wuhane, kde sa predávajú a konzumujú rôzne druhy exotických živočíchov, hľadajme pôvod vírusu medzi týmito živočíchmi s možným prenosom vírusu na človeka. Prvým adeptom sú netopiere, veď tie boli aj rezervoárom pre SARS-CoV v r. 2002. Po osekvenovaní celého genómu koronavírusu jedného druhu netopiera sa ukázalo, že jeho sekvencia je podobná genómu SARS-CoV-2 na 96 %, a to je vysoká podobnosť (podobnosť medzi genómami SARS-CoV a SARS-CoV-2 je iba 80 %). Zdalo sa, že sme rýchlo zistili pôvod nového vírusu.
Ale situácia je oveľa komplikovanejšia. Napriek blízkej genetickej príbuznosti netopierieho koronavírusu so SARS-CoV-2, sekvencia RBD z netopierieho koronavírusu je odlišná od RBD pre SARS-CoV-2, takže netopierí koronavírus nemôže byť priamym pôvodcom SARS-CoV-2, lebo by sa neviazal na ľudské bunky. Pri ďalšom hľadaní voľba padla na luskona (Obr. 4., ang. pangolin – Manis javanica) ilegálne importovaného z Malajzie do Číny, kde sa konzumuje jeho mäso a produkty sa využívajú aj v tradičnej čínskej medicíne.

Obr. 4. Luskon krátkochvostý
Osekvenovaním genómu koronavírusu z luskona sa prekvapujúco zistilo, že hoci celkový genóm je odlišný od SARS-CoV-2 (podobnosť len 85 – 92 %), RBD je podobná až na 97 %, pričom 6 kľúčových aminokyselín je úplne zhodných s RBD pre SARS-CoV-2 (Obr. 2.). Takže RBD pre ľudský SARS-CoV-2 vznikla prirodzenou selekciou!
Ale problém nie je tak jednoduchý. Sekvencia luskonieho kononavírusového S génu nemá druhé unikátne miesto – polybázické štiepacie miesto, tak ako žiaden iný koronavírus, s výnimkou SARS-CoV-2. Na úrovni dnešných vedeckých úvah toto unikátne štiepacie miesto vzniklo prirodzeným evolučným procesom s využitím mutácie, inzercie a delécie blízko spojenia S1 a S2 podjednotiek. Keď takýto nový vírus vznikol, preskočil na človeka vďaka takmer ideálnej RBD.
- Prirodzená selekcia u ľudí po prenose zo zvieracieho druhu
A čo keď nový vírus vznikol po prenose zo zvieraťa na človeka a potom selekčné procesy prebiehali až na ľudskom hostiteľovi? Scenár by mohol byť taký, že vírus preskočil na človeka z luskona (vďaka totožnej RBD) a proteolytické štiepacie miesto sa vyvinulo po prenose medzi infikovanými ľuďmi (o víruse u ľudí sme dovtedy nevedeli, lebo sa neprejavoval závažnými klinickými príznakmi). Túto hypotézu by bolo mohli potvrdiť cielené retrospektívne štúdie ľudských vzoriek získané pred vznikom pandémie.
- Selekcia na základe pasážovania koronavírusu
Objektívne nemôžeme vylúčiť ani možnosť, že vírus vznikol dlhodobým kultivovaním SARS-CoV na bunkových kultúrach. Veď vedci dlhý čas kultivovali SARS-CoV na bunkách a zvieracích modeloch v laboratóriách na celom svete. Dokonca sú objektívne známe isté úniky SARS-CoV z laboratórneho prostredia.
Teoreticky by snáď bolo možné, že dlhým pasážovaním SARS-CoV na bunkách vírus získa RBD pre SARS-CoV-2. Ale objavom koronavírusu u luskona s rovnakou RBD ako má SARS-CoV-2 je prirodzenejšie predpokladať, že nový pandemický koronavírus podchádza z tohto zvieraťa, než konštruovať kostrbaté teórie o laboratórnom pôvode SARS-CoV-2. A napokon je tu ešte nové proteolytické štiepacie miesto, ktoré zďaleka nepodporuje laboratórny pôvod vírusu.
Najrenomovanejší virológovia sveta sú absolútne presvedčení, že SARS-CoV-2 je prírodného pôvodu a vznikol bez úmyselného zásahu človeka. Poznanie pôvodu vírusu je dôležité preto, aby sme mohli lepšie predpovedať pandemické udalosti v budúcnosti, napr. aj zoonotickým prenosom z iného zvieracieho druhu.
Detekcia SARS-CoV-2 s využitím real-time RT-PCR
Získanie sekvencie SARS-CoV-2 umožnilo rýchly vývoj špecifickej detekčnej metódy, ktorá sa dnes masovo využíva na laboratórnu detekciu vírusu na celom svete vrátane Slovenska. V súčasnosti najspoľahlivejším laboratórnym testom detekcie SARS-CoV-2 je real-time RT-PCR, pri ktorej sa vo vzorkách výterov z hrdla a nosa deteguje vírusová RNA. Metóda je veľmi citlivá, lebo dokáže zachytiť vírus už v prvých dňoch virémie. Aj keď je to relatívne jednoduchá metóda, je tu niekoľko kritických bodov, ktoré môžu spôsobovať falošne pozitívne či falošne negatívne výsledky.
Nepríjemným krokom je izolácia vírusovej RNA z klinickej vzorky. Tá sa najčastejšie robí na špeciálnych kolónkach alebo extrakciou organickými rozpúšťadlami, kedy sa oddelia bielkoviny od nukleových kyselín. Pri neskúsenosti experimentátora hrozia straty vyizolovanej RNA alebo kontaminácia vzoriek. Následný krok RT-PCR sa skladá z pridania jednotlivých reakčných zložiek z kitu, čo je pomerne jednoduché. Po namnožení DNA na veľké množstvá, čo sa deje automaticky v prístroji termocyklér (zabezpečuje naprogramovanú zmenu teploty reakčného roztoku), sa deteguje množstvo DNA kontinuálne v reálnom čase.
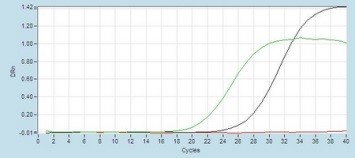
Obr. 5. Detekcia dvoch pozitívnych vzoriek s využitím real-time RT-PCR (amplifikačné krivky zelenej a modrej farby)
a jednej negatívnej vzorky (červená farba)
Čím viac vírusu je vo vzorke, tým silnejší registrovaný signál (Obr. 5., zelená amplifikačná krivka indikuje vo vzorke viac vírusu, ako je vo vzorke s modrou krivkou). Problémy nastavajú pri nízkej hladine vírusu vo vzorke, kedy sa ťažšie interpretujú výsledky, lebo sa pohybujeme v oblasti blízko detekčného limitu metódy. Je to v prípade, keď hodnota Ct (threshold cycle – hodnota prahového cyklu PCR, kedy exponenciálne stúpa amplifikačná krivka a je možné spoľahlivo hodnotiť pozitívny výsledok) je viac ako 35 (čo korešponduje len desiatkam až stovkám viriónov vo vzorke).
V ostatnom čase sa diskutuje, že do detekcie SARS-CoV-2 sa zapoja aj početné laboratóriá na Slovensku, čím bude možné analyzovať viac vzoriek. Tu však hrozí, že nie každé laboratórium zvládne túto metódu na primeranej úrovni. Zo skúseností s inými PCR testami vieme, že pri kruhových testoch, v ktorých tie isté slepé vzorky analyzujú viaceré laboratóriá, sú výsledky z rôznych laboratórií až prekvapujúco variabilné. Preto bude potrebné, aby sa priebežne kontrolovala kvalita prevedenia testov v laboratóriách s výsledkami na rovnakých vzorkách v rešpektovanom referenčnom laboratóriu.
Osekvenovanie niekoľkých stoviek kmeňov SARS-CoV-2 ukázalo, že aj keď je vírus čiastočne variabilný, nemá to vplyv na kvalitu diagnostických testov. Doteraz poznáme už 8 kmeňov z rôznych častí sveta, čo bude možné využiť v štúdiách molekulovej epidemiológie, kde sa hľadajú vzťahy medzi ohniskami nákazy.
Ďalšie problémy
Okrem iných poznatkov bude nesmierne užitočné zistiť, prečo SARS-CoV-2 je menej infekčný, ako bol SARS-CoV (mortalita 2 – 4 % versus 10 %). A sú tu aj ďalšie otázky zatiaľ bez odpovedí, napr. akú vakcínu vyvíjať proti COVID-19 (oslabený vírus, subjednotková vakcína na báze S proteínu, RNA vakcína a iné). V súčasnosti sa vakcíny proti tomuto koronavírusu vyvíjajú v 44 laboratóriách po celom svete. Analyzuje sa okolo 80 možných prístupov na prípravu vakcíny, pričom 4 vakcíny sú už v štádiu klinických skúšok. Aké budú odpovede na ďalšie otázky: ako pristúpiť k vývoju nového lieku, aký bude živočíšny model na štúdium patogenézy vírusu a iné, ako aj celý rad epidemiologických, imunologických a klinických problémov?
Trochu nádeje – a čo keď sa vírus spontánne stratí?
Skúsme byť optimistickí pri dodržaní kritického vedeckého myslenia. SARS-CoV, ktorý v r. 2003 spôsobil epidémiu v Ázii, sa náhle „stratil“ v priebehu r. 2004 a doteraz sa znovu neobjavil. Čo keď to bude aj prípad SARS-CoV-2?
Rekombinantný koronavírus (SeCoV) cirkuloval pred 5 rokmi aj v chovoch ošípaných v Taliansku, Nemecku a dokonca na dvoch farmách na Slovensku. SeCoV vznikol rekombináciou dvoch koronavírusov, ktorej výsledkom bola výmena S génu v genóme TGEV (transmissible gastroenteritis virus) za S gén z PEDV (porcine epidemic diarrhoea virus), čím vznikol rekombinantný koronavírus SeCoV (swine enteric coronavirus). Infekcia SeCoV sa klinicky prejavila silnými hnačkami s mortalitou 30 – 35 % u ciciakov, čo bolo popisané v našej vedeckej práci. Naše rozsiahle analýzy s detekciou koronavírusov na farmách ošípaných s využitím RT-PCR nepotvrdili tento koronavírus u žiadnej zo 150 vzoriek rektálnych výterov hnačkujúcich ciciakov na 15 farmách na Slovensku, čo indikovalo, že vírus sa nešíril do ďalších chovov. Nový chimerický koronavírus sa náhle stratil z európskych fariem ošípaných. Aj keď chov ošípaných nemožno porovnávať s ľudskou populáciou, predsa aj na tomto príklade existuje nádej, že by sa SARS-CoV-2 mohol po čase spontánne stratiť z cirkulácie.
A na záver
SARS-CoV-2 ako etiologický agens COVID-19 je názorným príkladom toho, aké dôležité je venovať pozornosť zoonotickým vírusom, teda vírusom spoločným pre ľudí a zvieratá, s najčastejším prenosom zo zvierat na ľudí. Pripomeňme, že v priebehu ostatných 18 rokov vznikli dve epidémie, spôsobené SARS-CoV (2003) a MERS-CoV (2012), a prebiehajúca pandémia spôsobená SARS-CoV-2 (2019 – 2020). Logické je predpokladať, že aj v budúcnosti nás čakajú ďalšie epidémie či pandémie spôsobené koronavírusmi alebo inými agensmi. Pevne verím, že úroveň našej vedy túto reálnu možnosť minimalizuje.
Podľa literárnych zdrojov spracoval: prof. Ing. Štefan Vilček, DrSc., vedecký pracovník na Katedre epizootológie a parazitológie Univerzity veterinárskeho lekárstva a farmácie v Košiciach (stefan.vilcek@uvlf.sk)